ক্রায়ো-ইলেক্ট্রন মাইক্রোস্কোপ: ভাইরাস চেনার ‘গুগল আর্থ’ ও নোবেল পুরস্কার (১)
ক্রায়ো-ইলেক্ট্রন মাইক্রোস্কোপ: ভাইরাস চেনার ‘গুগল আর্থ’ ও নোবেল পুরস্কার (১)
- 26 Apr 2019
 চঞ্চল চক্রবর্তী
চঞ্চল চক্রবর্তীBITS Pilani
ক্রায়ো - ইলেক্ট্রন মাইক্রোস্কোপের আবিষ্কার ও তার মাধ্যমে জৈব অণুর গঠন কাঠামো দেখিয়ে ২০১৭ সালে রসায়নে নোবেল পুরস্কার পেয়েছিলেন তিন বিজ্ঞনী — রিচার্ড হেন্ডারসন, জ্যাক দুবোসে ও জোয়াকিম ফ্রাঙ্ক। জিকা, ইবোলা, ডেঙ্গু, এইডস ইত্যাদি ভাইরাসের হাই-রেজোলিউশন ছবি তুলতে সক্ষম এই ক্রায়ো ইলেকট্রন মাইক্রোস্কোপ নিয়ে লিখছে চঞ্চল চক্রবর্তী। আজ প্রথম পর্ব।
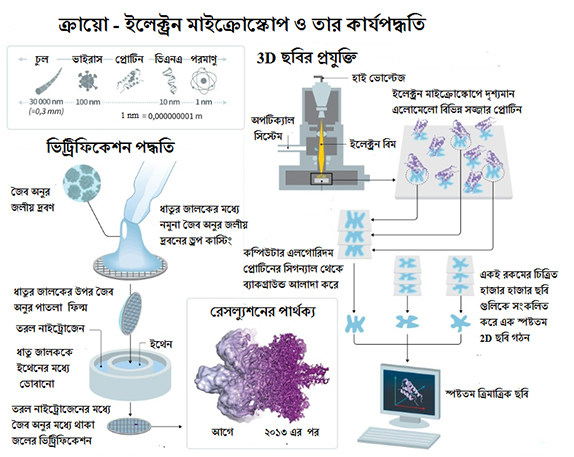
‘ঠান্ডা ঠান্ডা কুল কুল’…. আর এই ‘ঠান্ডা’ মন্ত্রেই চাক্ষুষ দেখা যেতে পারে জিকা, ইবোলা, ডেঙ্গি, এইডস, এমনকি ক্যান্সার বা আলঝাইমার্সের মতো ভয়ানক শত্রুদের! তাত্ত্বিক অর্থে এই ‘ঠান্ডা’ পদ্ধতিতে বিভিন্ন জৈব অণু, যেমন – প্রোটিন, ভাইরাস, ব্যাকটেরিয়া ইত্যাদির ত্রিমাত্রিক বা 3D গঠন দেখার প্রযুক্তি আবিষ্কার করে ২০১৭ সালে রসায়নে নোবেল পুরস্কার পান রিচার্ড হেন্ডারসন, জ্যাক দুবোসে ও জোয়াকিম ফ্রাঙ্ক। প্রচলিত ট্রান্সমিশন ইলেক্ট্রন মাইক্রোস্কোপির সাথে গুরুত্বপূর্ণ এক ‘কুলিং স্টেজ’ যুক্ত করে ছবি তোলার এক নতুন পদ্ধতির সূত্রপাত হয় ক্রায়ো-ইলেক্ট্রন মাইক্রোস্কোপ (ক্রায়ো-ইএম)-এর মাধ্যমে। বায়োকেমিস্ট্রির গবেষণা হয়ে ওঠে সহজতর। জীবদেহের ভিতরের জটিল থেকে জটিলতর জৈব অণুগুলির পরমাণু স্তরের ত্রিমাত্রিক ছবি, তাদের গঠন কাঠামো, মানবদেহে তাদের চলাচল (ডায়নামিক্স) ও আচার-আচরণ স্পষ্ট থেকে স্পষ্টতর ভাবে দেখা সম্ভব হয়েছে এই ‘ক্রায়ো-ইএম’ এর মাধ্যমে।১ এতদিন এক্স-রে ক্রিস্টালোগ্রাফি, নিউক্লিয়ার ম্যাগনেটিক রেসোনেন্স (NMR) স্পেকট্রোস্কোপি কিংবা ইলেক্ট্রন মাইক্রোস্কোপ দিয়ে অনেক অণুর গঠন নির্ভুল ভাবে নির্ণয় করা যেত না। সেই কাজটা খুব সহজ করে তুলেছে ‘ক্রায়ো-ইএম’। এর মাধ্যমেই সুচারু ভাবে সম্ভব হবে মানব দেহের বিভিন্ন রোগ সৃষ্টিকারী ভাইরাস, ব্যাকটেরিয়া কিংবা ক্যান্সারের টার্গেট প্রোটিন গুলিকে পর্যবেক্ষণ করা ও তাদের প্রয়োজনীয় প্রতিষেধক ঔষধ আবিষ্কার।২
জীবদেহের ভিতরের জটিল থেকে জটিলতর জৈব অণুর পরমাণু স্তরের ত্রিমাত্রিক বা 3D ছবি স্পষ্টভাবে দেখা সম্ভব হয়েছে ক্রায়ো-ইলেকট্রন মাইক্রোস্কোপের মাধ্যমে।

চিত্র ১ – ক্রায়ো-ইলেক্ট্রন মাইক্রোস্কোপের আবিষ্কর্তা: বাম দিক থেকে জ্যাক দুবোসে, জোয়াকিম ফ্রাঙ্ক ও রিচার্ড হেন্ডারসন। ছবির উৎস Science News Vol. 192 No. 7, October 28, 2017, p. 6 ক্রায়ো উষ্ণতা ও ক্রায়ো-ইএম কী ?
‘ক্রায়ো’ শব্দটি ‘ক্রায়োজেনিক’ (Cryogenic) শব্দ থেকে এসেছে। শব্দটির মানে হল খুব কম উষ্ণতা — মোটামুটি ভাবে -১৫০ oC এর নিচে।৩ এই কম উষ্ণতায় কোনো জৈব অণুর জলীয় দ্রবণকে সরাসরি এবং খুব তাড়াতাড়ি কঠিনে পরিণত করা হয়। এই পদ্ধতির নাম ভিট্রিফিকেশন। এই ভিট্রিফিকেশন পদ্ধতিতে কোনো জৈব অণুর চারপাশে থাকা জল খুব তাড়াতাড়ি জমে কঠিনে পরিণত হয়। অথচ, সেই জৈব অণুটির চেহারা অবিকৃতই থেকে যায়, এমনকি ক্রায়ো ই-এম যন্ত্রের অতি-শূন্য পরিবেশেও (ultra-high vacuum)। আগে তরল নাইট্রোজেন (-১৯৫.৭৯ °C) দিয়ে তৈরি করা হত এই ক্রায়ো উষ্ণতা। যদিও বর্তমানে নাইট্রোজেনের বদলে তরল ইথেনের (-১৮৮ °C) ব্যবহার হয়।৪
‘ক্রায়ো-ইএম’-এ এই জমে যাওয়া ভিট্রিফায়েড জৈব প্রোটিন অণুর উপর আলোর গতিবেগে ছুটে আসা ইলেক্ট্রনের স্রোত (যে ইলেক্ট্রনদের শক্তি ৮০-৩০০ কিলোভোল্টের মত) ফেলা হয়। বিশেষ ভাবে তৈরি এক ক্যামেরা এই ইলেক্ট্রনের ছবি ও ভিডিও তোলে। এত শক্তিশালী ইলেকট্রনগুলো প্রোটিন অণুটিকে ধ্বংস করতে পারে না তার আশেপাশে জমে যায় ‘ভিট্রিফায়েড’ জলের অণুর জন্য। অর্থাৎ, বলা যেতে পারে, ভিট্রিফিকেশন পদ্ধতি হলো ক্রায়ো-ইএম-এ ব্যবহৃত নমুনার (sample-এর) সুরক্ষার উৎসস্থল।
ক্রায়ো-ইএম যন্ত্রে কোন জৈব অণুর একই সাথে তোলা হাজার হাজার ঝাপসা ছবি থেকে কম্পিউটার অ্যালগরিদম ব্যবহার করে এক হাই-রেজোলিউশন ত্রিমাত্রিক বা 3D ছবি তৈরী করা হয়!
পুরনো প্রযুক্তির সীমাবদ্ধতা ও ‘ক্রায়ো-ইএম’-এর ঔৎকর্ষ
পঞ্চাশের দশক থেকে এক্সরে-ক্রিস্টালোগ্রাফির মাধ্যমে জৈব অণু বিশেষত প্রোটিনের গঠন কাঠামো দেখার কাজ শুরু হয়। আর তার আগে ১৯৩১ সালে জার্মান ইলেকট্রিক্যাল ইঞ্জিনিয়ার ম্যাক্স নোল ও জার্মান পদার্থবিদ আর্নস্ট রুসকা ইলেক্ট্রন মাইক্রোস্কোপ তৈরী করেন। তাঁর এই আবিষ্কারের জন্য ১৯৮৬ সালে আর্নস্ট রুসকা পদার্থবিদ্যায় নোবেল পুরস্কার পান। দুর্ভাগ্যবশতঃ নোবেল পুরস্কার ঘোষণার আগেই ম্যাক্স নোল ১৯৬৯ সালে মারা যান। অন্যদিকে ১৯৬২ সালে ব্রিটিশ ক্রিস্টালোগ্রাফার জে সি কেন্ড্রিউ ও অস্ট্রিয়াজাত ব্রিটিশ বায়োলজিস্ট ম্যাক্স পেরুজ এক্সরে-ক্রিস্টালোগ্রাফির সাহায্যে ‘গ্লোবিউলার প্রোটিন’-এর গঠন কাঠামো আবিষ্কার করে রসায়নে নোবেল পুরস্কার পান।৬ ওই সালেই ‘ডিএনএ’-এর ডাবল হেলিক্স গঠন আবিষ্কারের জন্য চিকিৎসাশাস্ত্রে নোবেল পুরস্কার পান ফ্রান্সিস ক্রিক, জেমস ওয়াটসন ও ফ্রেডেরিক উইলকিন্স। তারপর আশির দশকের শেষের দিকে ব্যবহার হতে শুরু করে NMR (Nuclear Magnetic Resonance) স্পেকট্রোস্কোপি। ১৯৯১ সালে সুইস বিজ্ঞনী রিচার্ড আর্নস্ট রসায়নে নোবেল পুরস্কার পান NMR স্পেকট্রোস্কোপি আবিষ্কারের জন্য। স্বাভাবিক ভাবেই প্রশ্ন উঠতে পারে যেখানে ইলেক্ট্রন মাইক্রোস্কোপ, এক্সরে-ক্রিস্টালোগ্রাফি বা NMR স্পেক্ট্রোস্কোপির মতো প্রযুক্তি ইতিমধ্যেই প্রোটিনের গঠন কাঠামো দেখার জন্য আবিষ্কৃত ও নোবেল পুরস্কার দ্বারা স্বীকৃত, সেখানে ক্রায়ো-ইএম পদ্ধতি এমন কী নতুন করে দেখালো যার ফলে আবার নোবেল পুরস্কার দিতে হল?
আসলে ক্রায়ো-ইএম পদ্ধতি আগের ব্যবহৃত তিনটি পদ্ধতির সীমাবদ্ধতা সহজেই অতিক্রম করেছে, আর জৈব অণুর ছবি তোলার পদ্ধতিকে সাফল্যের চরম শিখরে নিয়ে গেছে।৭
- প্রথমতঃ ক্রায়ো-ইএম পদ্ধতিতে যে জৈব অণুর ছবি তুলতে আমরা আগ্রহী, তাকে ‘ফ্রোজেন লিকুইড’ অবস্থায় ব্যবহার করা যায়। এক্সরে ক্রিস্টোলোগ্রাফিতে শুধু ক্রিস্টাল বা কেলাস ব্যবহৃত হয়। অনেক জৈব অণু যেমন জটিল পলিমারিক প্রোটিন কেলাস তৈরীই করে না, তাই তাদের জন্য ‘ক্রায়ো-ইএম’-ই একমাত্র ভরসা।৮ আবার ‘ক্রায়ো-ইএম’-এ যেহেতু প্রোটিনের দ্রবণ নিয়ে তাকে ‘ফ্রোজেন লিকুইড’ করা হয় তাই একসাথে একাধিক প্রোটিন অণুর গঠন কাঠামো দেখারও সুযোগ থাকে। ফলে অত্যন্ত জটিল প্রোটিন অণুর দশায় দশায় গঠন কাঠামোর পরিবর্তন অর্থাৎ ‘ফেজ ট্রান্সফরমেশন’ বোঝাও সম্ভব হয়েছে।
- দ্বিতীয়তঃ খুব সামান্য প্রোটিন অণু দ্রবণের মধ্যে হলেই কাজ হয়ে যায়, এনএমআর (NMR) স্পেকট্রোস্কোপি বা ক্রিস্টালোগ্রাফির মতো বেশি পরিমানে নমুনা প্রোটিন দরকার হয় না।
- তৃতীয়তঃ ক্রায়ো-ইএম পদ্ধতিতে ব্যবহৃত উন্নত কম্পিউটার অ্যালগোরিদমের জন্য এর ছবির রেজোলিউশন বা স্পষ্টতা প্রচলিত নেগেটিভ স্টেইনিং ট্রান্সমিশন ইলেক্ট্রন মাইক্রোস্কোপির থেকে অনেকটা বেশি।
- চতুর্থতঃ খুব ছোট ছোট প্রোটিন বা পেপটাইডের গঠন নির্ণয় করার জন্য এনএমআর (NMR) স্পেকট্রোস্কোপি খুব কার্যকরী। কিন্তু খুব বড় আকারের প্রোটিন যেখানে অনেক হাইড্রোজেন আর কার্বন অণুর উপস্থিতি সেখানে এনএমআর (NMR) স্পেকট্রোস্কোপি পদ্ধতি খুব জটিল এবং ত্রূটিপূর্ণ। এসব ক্ষেত্রে ক্রায়ো-ইএম পদ্ধতি খুব কার্যকরী।
- পঞ্চমতঃ আগেই উল্লেখ করা হয়েছে যে, ক্রায়ো-ইএম পদ্ধতিতে প্রোটিন অণুর চারপাশে কঠিন অবস্থায় ‘ভিট্রিফায়েড’ জল থাকার জন্য উচ্চশক্তির ইলেক্ট্রন স্রোত নমুনা প্রোটিনকে ক্ষতিগ্রস্ত করে না।
এইসব কারণের জন্যই ক্রায়ো-ইএম পদ্ধতি আধুনিক জৈব-রসায়ন গবেষণাতে অনেক বেশি গ্রহণযোগ্য ও কার্যকরী হয়ে উঠেছে। তাই ক্রায়ো-ইএম নিয়ে নোবেল কমিটির দাবি, ”এই গবেষণা জৈব রসায়ন দুনিয়ায় নিশ্চিত ভাবেই যুগান্তকারী”।
পরের পর্বে আমরা এই বিস্ময় যন্ত্রটির আবিষ্কারের পিছনে আরও কিছু কথা শুনব।
রেফারেন্স ও আরো বিশদে জানতে :
(১) Nature 2017, 550, 167.
(২) The Rise of Cryo-Electron Microscopy, spring 2016, 13-21.
(৩) https://en.wikipedia.org/wiki/Cryogenics
(৪) এক্ষেত্রে ক্রিস্টাল ও কাচ বা গ্লাসের গঠনগত পার্থক্য আলোচনা করলে ভিট্রিফিকেশন পদ্ধতির ধারণাটা পরিষ্কার হবে। কোনো দ্রবণকে দ্রুত জমিয়ে (quenched) ভিট্রিফিকেশন পদ্ধতিতে কাচ তৈরি হয়। এই দ্রুত জমিয়ে কঠিনে পরিণত হওয়ার ফলে দ্রবণের অণুগুলি স্থিতিশীল সজ্জায় (equilibrium configuration) আসার সময় পায় না — বিশৃঙ্খল (disordered) অবস্থাতেই কঠিনে পরিণত হয়। অন্যদিকে, ক্রিস্টাল কোনো দ্রবণ থেকে ধীরে ধীরে ঠান্ডা হওয়ার মাধ্যমে গঠিত হয় তাই, সংশ্লিষ্ট অণুগুলি একটি স্থিতিশীল সজ্জা পাওয়ার জন্য পর্যাপ্ত সময় পায়। সুতরাং, এক্ষেত্রে একটি সুশৃঙ্খল অণুসমষ্টির কেলাস বা ক্রিস্টাল তৈরী করে।
যদিও তরল নাইট্রোজেনের তাপমাত্রা অনেক কম (-১৯৫.৭৯ °C), ভিট্রিফিকেশন পদ্ধতিতে বর্তমানে তরল নাইট্রোজেন ব্যবহৃত হয় না। তরল নাইট্রোজেনের তাপ ধারণ ক্ষমতা ও তাপ পরিবাহিতা অনেক কম হওয়ায়, যখন কোনো সাধারণ তাপমাত্রার জলীয় দ্রবণের মধ্যে ফেলে দেওয়া হয়, তা গরম হয়ে ফুটতে শুরু করে এবং তা ভিট্রিফিকেশন পদ্ধতিকে মন্দীভূত করে। তরল নাইট্রোজেনের মাধ্যমে ভিট্রিফিকেশনের জন্য সময় বেশি লাগাতে এই পদ্ধতিতে ‘ভিট্রিফায়েড’ জলের পাশাপাশি বরফের ঘনক তৈরির সুযোগ থাকে। এক্ষেত্রে তরল ইথেনের তাপ ধারণ ক্ষমতা ও তাপ পরিবাহিতা তরল নাইট্রোজেনের তুলনায় বেশি, যদিও তাপমাত্রা মোটামুটি একই (-১৮৮ °C)। তাই, দ্রুত ও সঠিক ভাবে জৈব অণুর জলীয় দ্রবণকে ভিট্রিফিকেশনের জন্য বর্তমানে তরল ইথেন ব্যবহৃত হয়।
(৫) https://www.youtube.com/watch?v=026rzTXb1zw
(৬) J. Chem. Educ. 2014, 91, 2009−2012
(৭) Science News 2017, 192, 6.
(৮) Nature, 2015, 525, 172–174.
(৯) BBA – General Subjects 2018, 1862, 324–334
(১০)https://www.chemistryworld.com/news/explainer-what-is-cryo-electron-microscopy/3008091.article
(১১)https://phys.org/news/2017-10-nobel-winning-technique-google-earth-molecules.html(১২) Mol. Cancer Ther. 2009, 8, 626.
এরপর কম্পিউটার এলগোরিদম এর সাহায্যে ক্যামেরায় তোলা ছবি ও ভিডিও গুলিকে ‘এডিট’ করার পালা। জৈব অণুটির একই সাথে তোলা হাজার হাজার ঝাপসা ছবি থেকে এক স্পষ্ট বা হাই-রেজোলিউশন (৩ অ্যাংস্ট্রম-এর কম রেজোলিউশন) ত্রিমাত্রিক ছবি তৈরি করা হয়। এই ত্রিমাত্রিক ছবি থেকে ওই জৈব অণুর আণবিক গঠন কাঠামো বা আচার আচরণের পুঙ্খানুপুঙ্খ বিবরণ পাওয়া সম্ভব হয়।৫

No comments